Soal Data harga keelektronegatifan beberapa unsur sebagai berikut. Urutan unsur unsur dala

Soal Data harga keelektronegatifan beberapa unsur sebagai berikut. Urutan unsur unsur dala
Baca juga: Tabel Periodik: Pengertian dan Cara Membacanya. Keelektronegatifan suatu atom dipengaruhi oleh ukuran atom. Makin besar suatu atom, maka makin rendah keelektronegatifannya. Hal tersebut dikarenakan partikel yang bisa menarik elektron dalam suatu atom adalah proton yang bermuatan positif. Namun, proton berada di dalam inti atom.

Cara Mudah Menjawab Soal Keelektronegatifan (Kimia SBMPTN, UN, SMA) YouTube
Cara Mudah Menjawab Soal Energi Ionisasi Pemahaman mengenai energi ionisasi dan penjelasan mengenai cara mudah menentukan urutan unsur dan kestabilan unsur b.

Keelektronegatifan / Elektronegatifitas Suatu Unsur Adalah Sifat Yang Menyatakan tujuan dari
Sifat keelektronegatifan sangat penting dalam pembentukan ikatan antaratom. Recommendation for You Struktur Molekul Dasar Berbentuk Linear, Trigonal Planar, Trigonal Pyramidal, Bujur Sangkar, Tetrahedral, Trigonal Bipyramidal, dan Oktahedral

Keelektronegatifan unsur dalam satu periodekimia sma YouTube
Sedangkan, keelektronegatifan adalah kemampuan atom menarik elektron. Artinya, energi ionisasi dan keelektronegatifan adalah kebalikan. Dilansir dari Thought Co, atom dengan energi ionisasi yang rendah memiliki keelektronegatifan yang rendah juga karena inti atomnya tidak memberikan gaya tarik menarik yang kuat terhadap elektron.

Data harga keelektronegatifan unsurunsur dalam satu peri...
Sifat periodik unsur meliputi sifat fisis (jari-jari atom, energi ionisasi, afinitas elektron, keelektronegatifan, dan kelogaman) dan sifat kimia (titik leleh dan titik didih). Sifat-sifat periodik unsur ini adalah sifat-sifat yang ada hubunganya dengan letak unsur pada sistem periodik. Sifat sifat tersebut berubah dan berulang secara periodik.

PPT SIFATSIFAT PERIODIK UNSUR Jarijari atom Energi Ionisasi Afinitas elektron
Keelektronegatifan adalah kemampuan atom dalam molekul untuk menarik elektron ke dirinya. Semakin besar keelektronegatifan atom, semakin besar kemampuannya untuk menarik elektron ke dirinya. Kecenderungan elektronegativitas dalam tabel periodik dapat dilihat pada Gambar 1. Keelektronegatifan adalah salah satu tren tabel periodik. Cara

Urutan Keelektronegatifan Dari Unsur 11na 19k Dan 37rb RadarMadiun.co.id
Keelektronegatifan (simbol χ) ialah satu sifat kimia yang menjelaskan kecenderungan suatu atom atau kumpulan berfungsi menarik elektron (atau kepadatan elektron) ke arahnya. [1] Keelektronegatifan suatu atom dipengaruhi oleh nombor atomnya dan jarak elektron valens daripada nukleus atom. Semakin tinggi nombor keelektronegatifan, semakin banyak.
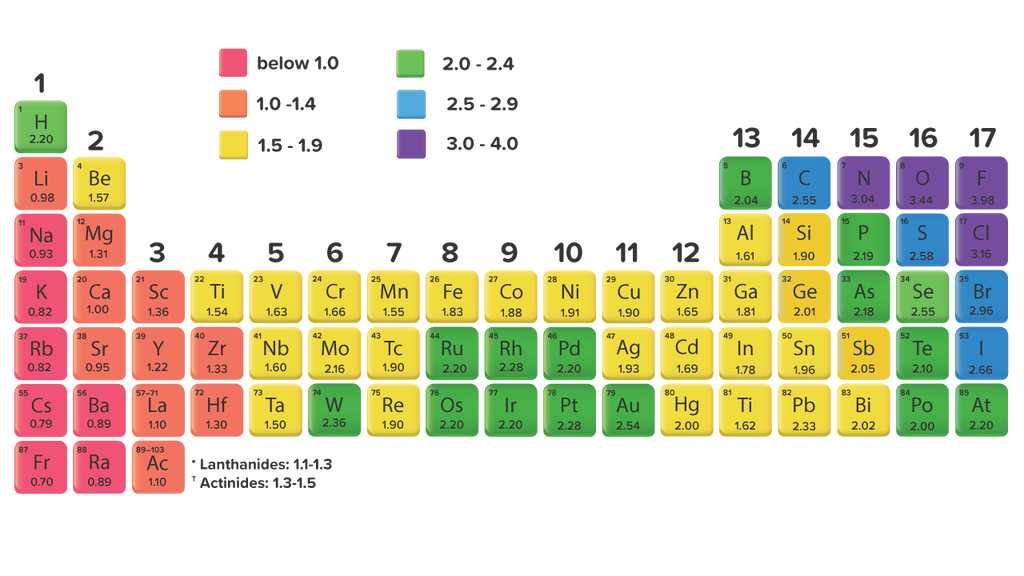
Unsur yang memiliki keeletronegatifan paling tingg...
Fransium dengan harga keelektronegatifan paling rendah yaitu 0,7 merupakan unsur yang sangat sukar menarik elektron atau lebih mudah melepaskan elektronnya. Dalam satu periode dengan bertambahnya nomor atom, keelektronegatifan cenderung makin besar. Dalam satu golongan dengan bertambahnya nomor atom, keelektronegatifan cenderung makin kecil.

Surah Al Falaq Urutan Keelektronegatifan Oksigen IMAGESEE
Avogadro dan ahli kimia lain mengkaji keelektronegatifan sebelum ia dinamakan secara rasmi oleh Jöns Jacob Berzelius pada tahun 1811. Pada tahun 1932, Linus Pauling mencadangkan skala keelektronegatifan berdasarkan tenaga ikatan . Nilai keelektronegatifan pada skala Pauling ialah nombor tanpa dimensi yang berjalan dari kira-kira 0.7 hingga 3.98.

Data keelektronegatifan beberapa unsur sebagai berikut. P...
Urutan Keelektronegatifan Dari Unsur 11na 19k Dan 37rb - Golongan IA periode 4 B. Golongan IA periode 5 C. Golongan II A periode 5 D. Golongan VII A periode 4 E. Golongan VIII A periode 5. 3. Dua unsur berada dalam keadaan yang sama dengan unsur-unsur yang nomor atomnya… A. 2 dan 3 B. 1 dan 11 C. 12 dan 17 D. 36 dan 37 E. 18 dan 19

Apa itu Keelektronegatifan Kimia Atom YouTube
Sama halnya dengan jari-jari atom, sifat keperiodikan unsur yang satu ini juga memiliki kecenderungan sebagai berikut: Dalam satu golongan dari atas ke bawah, energi ionisasi suatu unsur semakin kecil dikarenakan jari-jari atom bertambah besar, sehingga daya tarik inti terhadap elektron terluar semakin lemah dan energi ionisasi berkurang.

Soal Data harga keelektronegatifan beberapa unsur sebagai berikut. Urutan unsur unsur dala
Pembahasan Kepolaran suatu senyawa akan bertambah besar jika perbedaan keelektronegatifan atom - atom yang berikatan semakin besar. Adapun perbedaan keelektronegatifan antara HBr, HF, dan BrF adalah sebagai berikut Maka, urutan kepolaran yang semakin besar adalah HBr, BrF, HF Jadi, jawaban yang benar adalah

Diketahui data keelektronegatifan unsurunsur sebagai ber...
Elektronegativitas atau keelektronegatifan (Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuah gugus fungsi) untuk menarik elektron (atau rapatan elektron) menuju dirinya sendiri pada ikatan kovalen. Konsep elektronegativitas pertama kali oleh Linus Pauling pada tahun 1932 sebagai bagian dari perkembangan teori ikatan valensi.

Soal Data harga keelektronegatifan beberapa unsur sebagai berikut. Urutan unsur unsur dala
Pembahasan Keelektronegatifan akan bertambah dari kiri ke kanan dalam satu periode dan berkurang dari atas ke bawah dalam satu golongan. 8 O : 1s 2 2s 2 2p 4 (Golongan VIA, Periode 2) 9 F : 1s 2 2s 2 2p 5 (Golongan VIIA, Periode 2) 11 Na : 1s 2 2s 2 2p 6 3s 1 (Golongan IA, Periode 3) 17 Cl : 1s 2 2s 2 2p 6 3s 2 3p 5 (Golongan VIIA, Periode 3) Sehingga urutan yang tepat adalah: F > O > Cl.

Sifat Keperiodikan lainnya ? ada EI, AE dan Keelektronegatifan YouTube
Avogadro dan ahli kimia lainnya mempelajari elektronegativitas sebelum secara resmi dinamai oleh Jöns Jacob Berzelius pada tahun 1811. Pada tahun 1932, Linus Pauling mengusulkan skala elektronegativitas berdasarkan energi ikatan . Nilai keelektronegatifan pada skala Pauling adalah bilangan tak berdimensi yang berkisar antara 0,7 hingga 3,98.

Data keelektronegatifan beberapa unsur H=2,1;F=4,0;Cl=3...
Keelektronegatifan. Keelektronegatifan adalah kemampuan unsur untuk menarik elektron. Kemampuan ini dipengaruhi oleh jari-jari unsur.. Jika kita melihat urutan unsur periode 3, sifat unsur paling kirilah yang merupakan pereduksi atau reduktor paling kuat. Semakin ke kanan, sifat reduktor itu akan semakin lemah. Maka, jawaban yang paling.